【种花家务·物理】4-8-06玻尔的氢原子模型『数理化自学丛书6677版』
时间:2023-08-04 13:20:34 来源:哔哩哔哩
【阅前提示】本篇出自『数理化自学丛书6677版』,此版丛书是“数理化自学丛书编委会”于1963-1966年陆续出版,并于1977年正式再版的基础自学教材,本系列丛书共包含17本,层次大致相当于如今的初高中水平,其最大特点就是可用于“自学”。当然由于本书是大半个世纪前的教材,很多概念已经与如今迥异,因此不建议零基础学生直接拿来自学。不过这套丛书却很适合像我这样已接受过基础教育但却很不扎实的学酥重新自修以查漏补缺。另外,黑字是教材原文,彩字是我写的注解。
【山话嵓语】『数理化自学丛书』其实还有新版,即80年代的改开版,改开版内容较新而且还又增添了25本大学基础自学内容,直接搞出了一套从初中到大学的一条龙数理化自学教材大系列。不过我依然选择6677版,首先是因为6677版保留了很多古早知识,让我终于搞明白了和老工程师交流时遇到的奇特专业术语和计算模式的来由。另外就是6677版的版权风险极小,即使出版社再版也只会再版80年代改开版。我认为6677版不失为一套不错的自学教材,不该被埋没在故纸堆中,是故才打算利用业余时间,将『数理化自学丛书6677版』上传成文字版。
第八章原子的结构
 【资料图】
【资料图】
【山话|| 本系列专栏中的力单位达因等于10⁻⁵牛顿;功的单位尔格等于10⁻⁷焦耳;热量的单位卡路里等于焦耳;电荷的单位静库(1库伦=3×10⁹静库);电势的单位静伏等于300伏特。另外这套老教材中力的单位常用公斤、克等,但如今是不允许的,力是不能使用质量单位的。】
§8-6玻尔的氢原子模型
【01】卢瑟福的原子的核式结构模型虽然能够成功地解释 α 粒子的散射实验,但是这个模型本身却很难用当时的电磁理论来解释。因为绕核旋转的电子具有加速度,根据麦克斯韦的电磁理论可知,绕核旋转的电子必然会向周围空间不断辐射出电磁波,那么电子的能量就要不断地减少,于是它绕核旋转的半径也将不断地减小,最后电子必然趋近于核而落在核上。这样说来,原子就应该是一个不稳定的系统,同时由于电子本身能量不断减少,它发出的电磁波的频率也就应该不断地变化,那么我们所观察到的原子光谱也就应该是连续光谱。但事实上原子是十分稳定的,而且原子所发射的光谱是明线光谱而不是连续光谱。怎样来解决这个矛盾呢?1913年,丹麦物理学家玻尔在卢瑟福所提出的核式结构模型的基础上,首先把普朗克的量子理论推广到原子系统里来。他引用了普朗克的量子概念,提出了一种跟牛顿力学和麦克斯韦电磁理论根本相矛盾的假设,成功地解释了氢原子光谱。
【02】玻尔在卢瑟福的核式结构模型的基础上提出:氢原子是由一个带正电的核和一个绕核旋转的带负电的电子所组成的。为了研究方便,他假设电子绕核旋转的轨道是半径为 r 的圆,如果库仑定律和牛顿运动定律在原子区域内仍旧适用,假设 Ze 和 e 分别为氢原子核和电子所带的电量,那么它们之间的静电力 (对于氢原子核说来 Z=1)。
【03】根据牛顿运动定律,还可以把这个静电力看作是使电子绕核旋转作圆周运动的向心力,即 。
【04】式中 m 是电子的质量,v 是电子绕核旋转的线速度。于是就可以得出电子绕核旋转的线速度和轨道半径之间的关系式 。
【05】但是玻尔认为,电子绕核旋转的轨道并不是任意的,它只能在核外一定的轨道上旋转,这些可能轨道的周长和电子动量的乘积必须等于普朗克常数的整数倍。这就是说,电子运动的轨道半径 r 和电子的线速度 v 之间除了具有上述关系外还必须遵循另一个关系 (n=1,2,3…)。
【06】式中 h 是普朗克常数,数值等于 ×10⁻²⁷ 尔格·秒;n 是正整数。利用消去法把上述两关系式中的 v 消去后就可以得出氢原子中核外电子运动轨道半径的公式 (n=1,2,3…) 。
例2.试计算氢原子中核外电子运动的最小轨道半径和其他可能的轨道半径值。
【解】∵
已知:电子质量 m=×10⁻²⁸ 克,电子电量 e=×10⁻¹º 静电系单位电量,普朗克常数h=×10⁻²⁷ 尔格·秒,圆周率 π=。
∴ 。
【07】对于氢原子说来,Z=1;令 n=1,就得出氢原子中核外电子运动的最小轨道半径 r₁= 埃。这个数值跟由气体分子运动论推出的结果相一致。其他可能的轨道半径:
【08】可见核外电子只能沿一些不连续的圆周轨道运动。
【09】另外,玻尔还假设电子在这些可能的轨道上运动时,各具有一定的势能和动能,而并不向四周辐射能量,只有当电子以跳跃的方式从一个轨道跳到另一个轨道上时,才会和外界发生能量的交换。
【10】假设 En₁ 和 En₂ 是电子在轨道 n₂ 和 n₁ 上运动时所具有的能量,那么当电子从轨道 n₂ 跳跃到轨道 n₁ 上时,能量的改变为 。
【11】我们知道,能量是个相对的量。在正电荷的电场中,通常规定静止在无限远处的正电荷所具有的能量为 0,离正电荷愈近,能量就愈大。对于处在原子核电场中的电子说来:由于它带负电,所以情况正相反,电子的电势能总是负的,而且离核愈近,电势能负得愈多,即能量愈小。
【12】由此可知,当电子从离核较远的轨道 n₂ 跳跃到离核较近的轨道 n₁ 上时,就要放出能量。即当 时,将有一部分能量以光子的形式发射出来而形成原子的发射光谱(图8·13);而当电子从离核较近的轨道 n₁ 由于外界的原因跳跃到离核较远的轨道 n₂ 上时就要吸收能量,即当 时,将有一部分能量以光子的形式被电子所吸收而形成原子的吸收光谱。至于电子所发射或吸收的光子的频率并不决定于电子的能量,而决定于电子在跳跃前后所具有的能量差,即 。
【13】式中 h 是普朗克常数, 是光子的频率。由于电子的运动轨道半径是不连续的,因此电子所具有的能量以及它在跳跃前后能量的差也不可能是连续的。这就可以说明,为什么原子光谱是明线光谱而不是连续光谱。
【14】对于氢原子说来,原子核所带的电量是+Ze(Z=1)。电子在半径是 r 的轨道上运动时所具有的电势能【在原子核+Ze 的电场中,距核为 r 处的电势是】和动能分别是 。
【15】结果,电子所具有的总能量【严格说来,总能量 E 并不为电子单独所有,而是属于整个原子系统的,现在这样提是为了叙述上的方便。】 。
【16】又因 ,代入上式可得 。
【17】再以 代入上式可得 。
【18】以 n=1,2,3…代入上式就可以依次得出电子在各个可能轨道上运动时所具有的能量 E₁,E₂,E₃…。随着 n 的增大,E 的值逐渐增大,表示电子运动的可能轨道距核愈远,电子所具有的能量也愈大。
【19】当电子从第 n₂ 个轨道上跳跃到第 n₁ 个轨道上时(n₂>n₁),根据玻尔的假设,这时电子所发射的光子的能量 。
【20】那么光子的频率 。
【21】所发射谱线的波数 。
【22】式中 c 是光在真空中的传播速度。把这个玻尔理论的公式和由实验归纳出来的巴耳麦公式 比较一下,可见它们具有类似的形式。计算表明,在玻尔的理论公式中取 Z=1,那么公式中括号前的因子就是黎德堡常数,即 厘米⁻¹。这与从最精确的光谱实验里得出来的黎德堡常数 R=×10⁵ 厘米⁻¹ 符合得相当好,它说明玻尔理论在处理氢原子的问题上是十分成功的。
【23】根据玻尔理论,氢原子光谱的规律性可以这样来解释:当氢原子处在正常状态时,电子是在离核最近的 n=1 的可能轨道上运动,这时它的能量最少,也比较稳定;当原子受到光的照射或高能粒子的“碰撞”等外界因素的激发时【这里所谓“碰撞”并不一定是指高能粒子对电子的直接接触。也可以指对它的影响。】,电子就吸收一定的能量而跃入其他能量较高的(n=2,3,4…等)可能轨道上去,并处于激发状态,这时电子很不稳定,它能自发地跳跃到其他能量较低的可能轨道上来,同时发出一个光子,这个光子的能量就等于电子在跳跃前后所具有的能量差。从不同的能量较高的可能轨道上,跳跃到同一个能量较低的可能轨道上来时所发出的谱线都属于同一线系。
【24】例如,电子从 n=2,3,4,5… 等可能轨道上跳跃到 n=1 的可能轨道上来时所发出的谱线都属于赖曼线系,它们的波数 。
【25】电子从 n=3,4,5,6… 等可能轨道上跳跃到 n=2 的可能轨道上时所发出的谱线都属于巴耳麦线系,它们的波数 。
【26】电子从 n=4,5,6,7… 等可能轨道上跳跃到 n=3 的可能轨道上时所发出的谱线都属于帕邢线系,它们的波数 。
【27】图8·14就是有关氢原子光谱产生的示意图。
【28】一般说来,一个处于激发状态的氢原子在某一时刻只能发出一条谱线,为什么我们在氢原子光谱上总可以看到各种不同的谱线呢?这是因为在大量的氢原子中,处于激发状态的氢原子也有许许多多,它们各自处于不同的激发状态,因而发出的谱线也各不相同,所以我们总可以同时观察到它们所放射的全部谱线。
标签:
最新文章推荐
- 【种花家务·物理】4-8-06玻尔的氢原子模型『数理化自学丛书6677版』
- 姚振华被打,宝能发声
- 财政部两期国债中标结果出炉(08-04)
- A股七月“真金白银”回购超27亿元
- 台军九鹏基地被视为“神秘单位”
- 连接2个地铁站,这条便民服务公交明起开通
- 山西百名西部计划志愿者出征
- 或增持或回购,沪市公司真金白银强信心
- 沪深股通|万孚生物8月3日获外资买入0.10%股份
- 国家博物馆儿童怎么预约?
- 张文生:美国又“与台湾同在”?谁信
- 侮辱遇难的救援队队员、诋毁烈士…297个微博账号被禁言
- 海棠木与胡桃木哪个贵(海棠木和胡桃木哪个好)
- 支付宝怎么升铂金 支付宝升铂金方法 支付宝升到铂金需要花多少钱
- 华联控股:公司自持物业目前按成本法计量
- 第四届中国人工智能大赛成果发布会在厦门举办 12个团队获得A级证书
- 公安部发声放开超大城市落户名额!上海购房需求会爆发吗?
- 广东宏大业绩快报:上半年净利润同比增长26.89%
- UGA将乌克兰2023年谷物和油籽总产量预估上调至7680万吨金十期货8月3日讯,据外媒报道,乌克兰粮食贸易商联盟UGA周四表示,1.将乌克兰2023年谷物和油籽总产量预估上调近800万吨,至7680万吨
- “煤城”不产煤之后——一个西部资源枯竭型城市的转型调查
X 关闭
资讯中心
 部分宠物店寄养价格上涨 或因节日寄养需求增加
部分宠物店寄养价格上涨 或因节日寄养需求增加
2023-01-17
 OPPO首个自研智慧跨端系统发布 连续四年首发
OPPO首个自研智慧跨端系统发布 连续四年首发
2022-09-16
2021-10-18
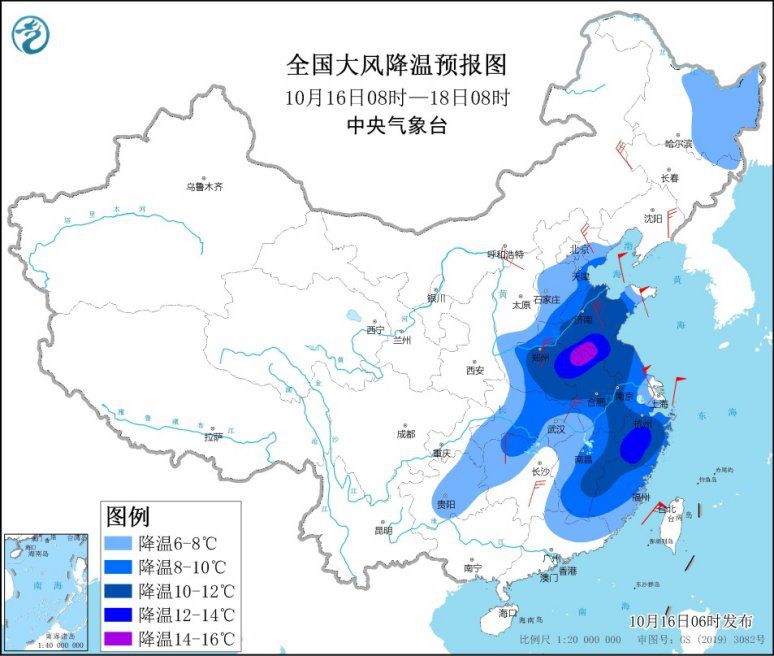 强冷空气继续影响中东部地区 局地降温14℃以上
强冷空气继续影响中东部地区 局地降温14℃以上
2021-10-18
X 关闭
热点资讯
-
1
环球观焦点:中国数码信息(00250.HK):中期录得溢利700万港元 继续停牌
-
2
【全球聚看点】12月29日泛在电力物联网板块十大熊股一览
-
3
以网络文学书写时代的壮丽多姿
-
4
水枪大混战作文600字(通用10篇)
-
5
天天消息!重庆:未来半年内到期的房地产融资可在原规定基础上多展期1年
-
6
【港股通】上海医药(02607):吸入用硫酸沙丁胺醇溶液获国家药监局注册批准
-
7
志晟信息(832171)12月29日游资资金净卖出16.86万元_每日信息
-
8
新易贷商户贷款逾期多长时间会上征信
-
9
焦点快播:国联股份:公司是否造假问题实在不值得驳斥。至于股价波动,公司本身无法也不能够予以干预
-
10
从“蜗牛慢跑”到“猎豹速跑” 广西提升基层政务服务办事效率 环球速讯
-
11
冬天太干嘴起皮,什么食物护唇? 当前要闻
-
12
B站公布2023年内容招商版图:推出“MATES人群模型” 快讯
-
13
2023年国家博物馆元旦放假吗?开放时间一览
-
14
当前观察:苯泄露有什么危害,有什么预防措施?
-
15
环球热讯:厦门2023兔年纪念币余额查询入口(中行+建行+工行+邮储)
-
16
2023年贺岁普通纪念币江苏省预约兑换公告|天天即时看
-
17
中间价调升279个基点!机构:短期人民币仍在寻找方向|天天信息
-
18
做了30年的女配角,卖别墅为丈夫还债,如今无儿无女退休金2500,依旧乐此不疲地折腾着
-
19
卧龙地产: 卧龙地产2023年第一次临时股东大会会议资料
-
20
焦点速递!湖南关于已参与市场交易用户改为电网企业代理购电有关事项的提示